Dans les cours d’eau la matière organique dissoute (MOD) recouvre un très grand nombre de molécules, issues d’apports naturels ou anthropiques (pollutions) plus ou moins transformés lors du transport dans les sols et le milieu aquatique. Pour exemple, les acides organiques naturels comme les acides fulviques, qui sont ubiquitaires des eaux de surface, sont des mixtures complexes de milliers de molécules présentant une grande variété dans leurs caractéristiques chimiques (composition, aromaticité, acidité, groupes fonctionnels…) -et par conséquent, dans leur réactivité chimique-. Les interactions entre ces molécules de la MOD, les métaux et les particules colloïdales déterminent les principales caractéristiques des systèmes aquatiques de surface, incluant teneurs en carbone et azote dissous des eaux, spéciation aqueuse et mobilité des métaux, et capacités de sorption de la phase colloïdale / en suspension vis-à-vis des contaminants.
Caractériser l’évolution spatio-temporelle de la MOD dans nos systèmes aquatiques est donc un challenge dont l’enjeu est la compréhension / l’anticipation de la qualité chimique de nos cours d’eau. Au regard de l’enjeu, la communauté scientifique ne se contente plus, depuis de nombreuses années, de simples analyses élémentaires pour déterminer les teneurs en carbone ou azote dissous, lesquelles n’apportent pas d’information quant à l’origine (naturelle vs. anthropique) ou à la réactivité de la MOD. Des méthodes optiques (spectroscopie UV-visible, fluorescence)[1],[2] sont mises en œuvre : elles permettent de comparer les MOD en termes de poids moléculaire, d’aromaticité, etc. mais cela reste limité. Elles ont l’avantage pour certaines d’entre elles d’être utilisables in-situ et de permettre un suivi en continu de la réponse de systèmes aquatiques à des perturbations telles que des crues ou des déversements. L’avènement de la spectrométrie de masse à ultra haute résolution, en particulier quand elle est combinée à des sources électrospray (Electrospray ionisation Fourier Transform Mass spectrometry, ESI-FTMS), a ouvert des voies de recherches émergentes sur l’identification des molécules organiques présentes dans nos écosystèmes. Cette technique analytique performante est l’une des seules techniques permettant d’identifier (détermination de la formule chimique brute et –et éventuellement structure- de la molécule) de manière fine et univoque les milliers de molécules organiques qui coexistent dans un échantillon naturel, grâce à sa ultra-haute résolution, sa grande précision en masse, sa sensibilité, sa capacité à respecter les abondances isotopiques et à fournir des spectres MSn. La technique est appliquée depuis récemment -et de manière croissante- à l’identification exhaustive (scanning) des micropolluants organiques dans les eaux de surface et de nappe[3], des molécules constitutives des substances humiques des sols[4],[5], et de celles constituant la MOD[6]. Détecter et obtenir la formule chimique brute de chaque molécule (et donc son rapport O/C et H/C) dans un échantillon permet non seulement d’avoir une vision de la complexité de celui-ci (nombre et diversité des molécules organiques) mais surtout des informations détaillées et spécifiques sur les caractéristiques des molécules (e.g. degré d’aromaticité, hydrophobicité, acidité, fonctionnalités) présentes dans un environnement donné. Un avantage est d’accéder à une connaissance approfondie des différences et similitudes existant entre matières organiques de différentes origines (anthropiques vs. naturelles), d’environnements divers (sols vs. eaux), ou de l’évolution des caractéristiques chimiques de la MOD dans l’espace ou le temps.
C’est dans ce cadre qu’un projet inter-ZA a été monté en 2016 visant à comparer les approches par méthodes optiques et spectrométrie de masse sur différents cours d’eau de tête de bassin. L’intérêt de ce projet à l’échelle interZA (ZAEU, ZAM, ZABR, ZAA, ZA Seine, ZAL) est de pouvoir bénéficier d’un panel de conditions géomorphologiques, géologiques, hydrologiques, géochimiques et de pressions anthropiques variées.
La carte des sites de prélèvement 2016-2017
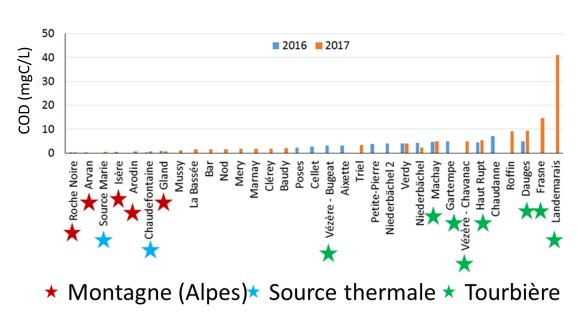
Le gradient de carbone organique dissous selon les types/sites de prélèvement
[1] Pons et al. 2011, WST, 64 (3) 602-609.
[2] Assaad et al. 2015, EMAS, 187 (4) 188
[3] Reemtsma T. et al. 2013. Water Research, 47, 5535-5545.
[4] Galindo C., Del Nero M. 2015. RSC Advances, 5, 73058 – 73067.
[5] Galindo C., Del Nero M. 2014. Environ. Sci. Technol., 48 (13), 7401–7408.
[6] D’Andrilli J. et al. 2015. Rapid Commun. Mass Spectrom., 29, 2385–2401.
